

Les
isoenzymes datant de 1960, sont encore utilisés comme marqueurs moléculaires chez les plantes, animaux L'évolution moléculaire a permis de montrer que certaines protéines (ensemble d'acides aminés), comme les cytochromes ou les hémoglobines chez plusieurs organismes, ont évolué à un rythme constant par substitutions successives d'acides aminés.
Ceci signifie que des mutations 'tolérables' par le DNA apparaissent à un taux constant dans le temps. Aussi, une population P, étudiée pour un locus donné, ne sera plus identique à elle même après un intervalle de temps t.
Son changement peut être prévisible en considérant les paramètres t (en années) et , taux de substitution par année d'un acide aminé par un autre pour une protéine moyenne dans la population P.
Les valeurs de sont de l'ordre de 10-8 à 10-9/an/site d'acide
aminé. L'analyse des isoenzymes par électrophorèse
révèle la différence d'états alléliques
par molécule de protéine entière (non pas par acide
aminé).
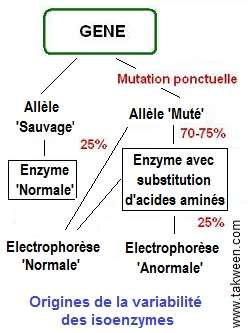
Origines de la variation détectée par électrophorèse
Les
isoenzymes correspondent à différentes formes d'une même
enzyme, catalysant la même réaction, mais dont les propriétés
physico-chimiques (charge électrique, taille,...) sont différentes.
Les isoenzymes peuvent être d'origine cytosolique ou plastidique.
Leur séparation par électrophorèse,
sur gel d'amidon ou de polyacrylamide, est due à plusieurs facteurs.
Modification de la charge électrique.
La modification de la charge d'une protéine suite à un
changement de la structure primaire, peut résulter d'une mutation
ponctuelle, par exemple. Les conséquences qui en résultent
peuvent donner des électrophorèses "anormales"
(Jacobs, 1975). Seules les substitutions d'acides aminés qui
diffèrent par leurs charges peuvent être détectées.
Une proportion de 25% seulement, de substitution conduit à un
changement de charges électriques.
* Acides aminés acides (charge négative) : Ac.aspartique et Ac.glutamique.
Acides aminés basiques (charge positive) : Lysine,
Arginine et Histidine.
Ce sont les radicaux R de la structure primaire des protéines qui affectent la charge électrique à l'ensemble de la molécule.
Les 20 acides aminés peuvent être répartis en 3 groupes selon la charge électrique des radicaux R
Composition en Acides aminés (AA) d'une protéine moyenne (d'après
King, J.L. & Jukes, T.H. 1969. Non-darwinian evolution.Random fixation of selectively neutral mutations.Sciences 164, 788-798.). Modifié par addition de pI.

Une protéine composée des 3 groupes d'AA. Aura une charge nette négative ou positive dépendant de la balance des charges en fonction du pH et de l'exposition des radicaux selon l'environnement et l'association des polypeptides. Un pH faible est en faveur des charges +. Un pH élevé est en faveur des charges -
Modificationspost-traductionnelles.
Les modifications post-traductionnelles conduisant aux associations de sous-unités et la mise en place de structures tertiaires ou quaternaires, formation de complexes avec des glucides et des acides nucléiques, adénylation, phosphorylation, dégradation
sélective...
Exemples de modifications post-translationnelles :
- Déamidation des résidus de la glutamine ou d'asparagine d'une isoenzyme.
- Oxydation des groupements thiols.
- Addition de groupements phosphates.
- Addition ou délétion de groupes carbohydrates.
- Clivage d'une partie d'un polypeptide par protéolyse enzymatique.
- Polymérisation ou agrégation.
- Conformation de l'enzyme.
- Effet de la concentration des cofacteurs. Les enzymes requièrant des cofacteurs (NAD, NADP) peuvent montrer une variation dans leur mobilité électrophorétique, dépendant du degré de saturation
de l'enzyme avec le coenzyme. La concentration de celui ci ne doit pas être limitante.
La révélation des isoenzymes est effectuée directement sur le gel ayant servi de support de séparation électrophorétique. La réaction enzymatique est à l'origine de l'apparition d'une ou plusieurs bandes colorées.
Casdes hydrolases :
Les enzymes sont rendues visibles sur gel par utilisation de substrats chromogènes ou fluorogènes qui donnent des produits colorés ou fluorescents après action de l'enzyme. Ainsi, par exemple, La libération de - ou -naphtol permet, ensuite, sa combinaison à un "Azodye" (Fast Garnett, Fast blue RR, ...) pour donner un précipité coloré. C'est le cas des estérases et des phosphatases :
Alpha-naphtyl-phosphate
----> Alpha-naphtol
Alpha-naphtol + Azodye ---> Précipité coloré
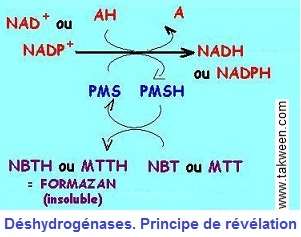
Cas des déshydrogénases
Les déshydrogénases (DH) catalysent le transfert d'atomes d'hydrogène de leur substrat à un coenzyme (NAD+ ou NADP+). L'atome d'hydrogène, libérée sous l'action de la
DH, peut être transférée, en présence de phénazine méthosulfate (PMS), sur un sel de tetrazolium, tel que Nitro Blue Tetrazolium (NBT) ou Méthyl Thiazolyl Tetrazolium (MTT)qui donnent alors un précipité insoluble bleu, le formazan.
Cas des transférases et des isomerases
Les transférases, comme la phosphoglucomutase (PGM) et les isomérases, comme la glucose phosphate isomérase (PGI), peuvent être visualisées indirectement, car, elles peuvent fournir un produit qui peut être déshydrogéné par une autre enzyme
(enzyme indicatrice) utilisant un des coenzymes NAD+ ou NADP+:

* GPDH : glucose 6-phosphate déshydrogénase (enzyme de la réaction indicatrice).
L'enzyme de la réaction indicatrice, ne pouvant pas diffuser rapidement dans le gel, le mélange réactionnel est étalé en une couche mince d'agarose sur le gel de séparation.
Les causes de l'apparition des isoenzymes sont de 3 ordres :
- Existence de plusieurs loci codant pour des chaînes polypeptidiques différentes.
- Existence d'allèles multiples au niveau d'un seul locus déterminant,
ainsi, des versions différentes de la chaîne polypeptidique.
Existence de modification posttranslationnelles de la structure enzymatique
donnant, ainsi, des 'isoenzymes secondaires'.
- Loci multiples à l'origine des isoenzymes
Il paraît que 25% des enzymes ont à leur origine plusieurs loci qui codent pour différentes chaînes polypeptidiques
d'une même enzyme. Cet état est attribué aux duplications
des gènes au cours de l'évolution. Ces gènes dupliqués divergent ensuite dans leur structure grâce aux mutations. Plus
que 4 loci ont été décrits pour certaines enzymes.
Les polypeptides résultant de l'expression des loci peuvent être synthétisés avec la même vitesse et se trouvent,
en même temps, dans la même cellule. Dans certains cas,
il existe une différence dans la vitesse
de leur synthèse dans les cellules de différents
tissus. La vitesse de synthèse peut être fonction du stade
de développement (exemple LDH).
- Allèlisme multiple au niveau des loci
Au niveau de chaque locus, un ou plusieurs allèles peuvent exister
dans une population d'individus. Chaque allèle codant pour une
version structurale différente d'une même chaîne
polypeptidique. Par conséquence, les structures primaires des
isoenzymes différeront d'un individu à un autre, selon
les allèles présents au niveau d'un locus donné.
Le profil électrophorétique dépend des états
suivants :
* Nombre d'allèles présents au niveau du locus.
* Etat monocaryotique ou dicaryotique de la cellule.
* Ploïdie (haploïde, diploïde, polyploïde).
* Arrangement génétique (homozygote, hétérozygote)
de l'organisme.
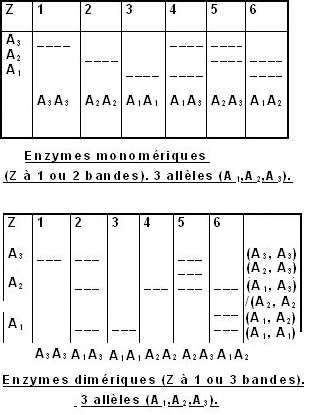
* Structure quaternaire de l'enzyme (monomère, dimère,...).
- Les individus haploïdes ou homozygotes donnent des zymogrammes
simplifiés répondant à l'expression d'un seul allèle.
Cas de 2 allèles (exemple de la Glutamate
Oxaloacétate Transaminase (GOT) du palmier dattier)


Pour
une enzyme dimérique, la bande intermédiaire ( ) est plus intense que les bandes extrêmes. Si les chaînes polypeptidiques produites par les 2 allèles s'associent au hasard, la moitié
(1/2) des molécules enzymatiques seront des hétéromères et un quart (1/4) correspondra à chaque homodimère.
En général, si le nombre de sous-unités identiques présentes dans la structure d'une isoenzyme d'un homozygote est n, le nombre d'isoenzymes présentes dans un hétérozygote
sera n + 1.
Remarque:
Tous les hétéropolymères ne sont pas nécessairement
formés. Ainsi, un zymogramme à 4 bandes permet de conclure
que l'enzyme est constituée d'au moins 3 sous-unités.
Vidéo explicative (Ar. Fr):
Cette enzyme qui transforme le lactate en pyruvate, est un tétramère (n = 4) à 2 sous-unités différentes alpha et Béta correspondant aux allèles alpha et Béta qui donnent naissance non seulement aux isoenzymes homomériques avec comme structure Alpha-Alpha-Alpha-Alpha et Béta-Béta-Béta-Béta (les autres combinaisons alléliques n'apparaissent pas ?), mais également aux isoenzymes hétéromériques comme Alpha-Alpha-Béta-Béta et Alpha-Béta-Béta-Béta. Les 5 isoenzymes varient largement dans leur proportion. Dans certains tissus (foie et muscle squelettique), le polypeptide Alpha est produit en grande quantité par rapport au polypeptide Béta.
Par
contre, dans d'autres tissus (ceur, rein) l'inverse est observé.
Ainsi, les profils électrophorétiques observés tendent
à être très asymétriques.
Isoenzymes hétéromériques dues à l'expression simultanée de plusieurs loci, en même temps.
Dans certains cas, les isoenzyme hétéromériques contiennent des sous unités polypéptidiques provenant de différentss loci.
Exemple 1 : cas d'une enzyme dimérique codée par 2 loci
(A et B) et 2 allèles par locus ( 1, 2 et 1, 2).

Exemple 2 : Phosphoglucose isomerase (PGI)

En
général, si un individu arrive à devenir hétérozygote
sur un ou plusieurs loci, le nombre des isoenzymes attendu (i) dans ces
conditions est donné par la relation suivante :
i
= [ (L + h + n - 1)! ]/ [ n !(L + h - 1) !]
où L = nombre de loci, h = nombre de loci à l'état hétérozygote
et n = nombre de sous-unités par enzyme.
Exemples :
- Une enzyme tétramérique (n = 4) (comme LDH), avec 2 loci (L =2) et où un des loci est hétérozygote (h = 1), aura comme nombre total d'isoenzymes,
i = 6!/(4! x 2!) = 15.
- Une enzyme dimérique (n = 2) (comme l'alcool déshydrogénase,
ADH du foie), avec hétérozygotie sur un seul des 3 loci
: L = 3, h = 1 et n = 2 donne i = 10 isoenzymes.
- Les Glucose-Phosphate-Isomérases (GPI) des Téléostéens
(Poissons) est un exemple de la formation d'isoenzymes hétéromériques
entre 2 loci Gpi-1 et Gpi-2 (voir interprétation des zymogrammes).
- Isoenzymes hétéromériques des cellules hybrides
somatiques interspecifiques. Dans ce cas des isoenzymes hétéromériques
contenant les chaînes polypeptidiques codées par les gènes
homologues des 2 espèces différentes sont toujours formées
chez les cellules hybrides provenant d'une hybridation somatique entre
des espèces différentes. Les isoenzymes hétéromériques
interspécifiques sont formées avec un caractère différent
des isoenzymes homomériques de chaque espèce. Dans de tels
cas, les zymogrammes ressemblent à ceux des hétérozygotes.
 |
 |
 |  |
Isoenzymes secondaires
Les loci multiples avec allélisme multiple constituent les bases génétiques qui définissent les séquences d'AA des chaînes polypeptidiques qui engendrent, à leur tour, des isoenzymes particulières. Néanmoins, la complexité de plusieurs systèmes enzymatiques ne revient pas, totalement, à cette notion seule. En effet, des modifications secondaires de la protéine enzymatique prennent lieu pendant la synthèse des chaînes polypeptidiques et deviennent responsables de la complexité des zymogrammes. Les isoenzymes générées par ces changements 'post-translationnels', sont appelées 'isoenzymes secondaires.
Présence d'allèles nuls Certains gènes de structure présentent des allèles qui ne fournissent aucun produit révélable par électrophorèse.
Ces allèles sont appelés 'silencieux' ou 'nuls'. Ils sont
récessifs. Les hétérozygotes ayant un allèle
nul N et un allèle actif A (individus AN) présentent le
même phénotype électrophorétique que les homozygotes AA. Quant aux homozygotes NN, ils ne montrent aucune bande. Néanmoins, les hétérozygotes AN peuvent être caractérisés par des bandes moins intenses que les homozygotes AA. Liens utiles: - Isoenzymes (TD). QCM formatif Video 'genetic diversity through molecular markers' (master level, Cadi Ayyad University, 2019: -
Faire un Quiz formatif (Contrôle noté) sur les Biotechnologies
des Plantes et Marqueurs moléculaires Télécharger les ARCHIVES des EXAMENS du MODULE 'BIOTECHNOLOGIES et AMELIORATION des PLANTES'.
Pour s'assurer de la présence d'un allèle nul, il faut faire des croisements, car la progéniture des hétérozygotes est prévisible. Aussi, il faut effectuer des électrophorèses
répétitives pour s'assurer de la différence d'intensité
des bandes des hétérozygotes AN.
Les allèles nuls sont fréquents parmi les gènes
qui codent des estérases.
Interprétation des zymogrammes. Exemples.
L'interprétation génétique des zymogrammes (Z)
est basée sur 2 approches successives :
- Comparaison de tous les Z observés. On peut présumer
un déterminisme génétique en relevant l'hypothèse
explicative la plus simple.
Les hypothèses sont confrontées à l'analyse mendélienne
de croisements entre des individus présentant des Z différents
(F1, F2, BC,...).
L'interprétation fait appel aux considérations suivantes
:
1 / Individus homozygotes ou hétérozygotes ?
Les isoenzymes sont des marqueurs contrôlés par des allèles
codominants. Il est plus facile de distinguer les homozygotes des hétérozygotes.
2/ Structure quaternaire de l'enzyme ?
Les hétérozygotes présentent un zymogramme à
au moins n+1 bandes, avec n = nombre de sous-unités de l'enzyme.
3/ Nombre de loci ?
Ceux ci sont caractérisés, entre autres, par des variations
indépendantes des positions des bandes.
4/ Nombre d'allèles ?
Un allélisme multiple est à l'origine d'un nombre élevé
de phénotypes électrophorétiques.
Enzymes monomériques (Z à 1 ou 2 bandes).
2 allèles (A1, A2).
- Marqueurs moléculaires. QCM formatif
- RFLP et sélection des protoplastes chez l'oranger. Examen S5_2012
- RAPD et amélioration de la tomate pour la résistance à la verticilliose, RFLP. Examen S5_2012
- RFLP, RAPD et sélection
chez le Cyprès du Japon (examen 2013)
- SSR (microsatellites)
et mildiou de la tomate (Examen S5, 2013)
- Marqueurs PCR de type
RAPD et microsatellites chez coton (Contrôle S5, 2014)
- Isoenzymes et détection d'hbrides interspécifique chez Cuphea
- Marqueurs RAPD et SSR et test de la pureté des semences chez la tomate (examen 1, 2019


Biotech-ecolo. net. Supports
CHAINE YOUTUBE Chaine Youtube (abonnement). Plusieurs vidéos
multilingues (+ s/titres) aux sujets des Biotechnologies et Biochimie
OUVRAGES
- Glossaire
trilingues Français-Arabe-Anglais
